Wie das zirkuläre Modell konkret funktioniert und warum es dem hierarchischen überlegen ist – Das Beispiel der ketogenen Diät
Soeben ist eine neue Publikation von uns in einer Online-Zeitschrift erschienen, in der wir vorgeführt haben, wie man das zirkuläre Erkenntnismodell konkret umsetzen kann [1]. Die Federführung hatte der Physiker Rainer Klement, der die Analyse gerechnet und die Beispieldaten zur Verfügung gestellt hat. Ich konnte ihn für meine Idee begeistern, dass man mit einem zirkulären Erkenntnismodell mehr Einsicht gewinnt als mit dem traditionellen, hierarchischen der „evidence based medicine (EBM)“. Der Schlüssel dazu könnte die hier vorgenommene Formalisierung sein, die einen Bayesschen statistischen Ansatz wählt. Das klingt komplizierter als es ist.
Hintergrund und Problem
Das hierarchische Modell der EBM, das derzeitige Mainstream-Modell, geht davon aus, dass randomisierte, kontrollierte Studien, wenn möglich mit Placebo-Kontrolle, die best verfügbare Erkenntnis dazu liefern, ob eine Intervention wirkt oder nicht. Implizit setzt es damit interne Validität, die methodische Stringenz und Gültigkeit einer Studie, gegen die externe Validität, die Übertragbarkeit, Brauchbarkeit und Generalisierbarkeit von Erkenntnissen in der Praxis. Diese Probleme habe ich in den ersten drei Teilen meiner Methodenlehre analysiert (Teil 1: Evidenz, ein unreflektierter Kampfbegriff; Teil 2: Hierarchie oder Zirkel der Erkenntnis; Teil 3: Die Konsequenzen des hierarchischen und zirkulären Modells).
Das führt in der Praxis dazu, dass systematische Übersichtsarbeiten und Meta-Analysen die meisten Daten ausser Acht lassen und oft sogar sagen, es gäbe keine wissenschaftlichen Erkenntnisse. Daher enthalten medizinische Leitlinien oder Meta-Analysen oft Empfehlungen, die der klinischen Erfahrung widersprechen oder eine Menge Einsichten nicht berücksichtigen [2]. Das Problem, das haben wir in anderen Publikationen analysiert [3, 4] und in Teil 18 des Methodenblogs ausführlicher dargestellt, liegt darin, dass interne und externe Evidenz voneinander unabhängig sind. Man kann nicht so tun, als wäre das eine wichtiger als das andere oder als würde das eine das andere voraussetzen. Tun sie eben nicht. Vielmehr gibt es Studien, die maximieren die interne Validität – randomisierte Studien – und solche, die maximieren die externe Validität – alle naturalistischen Studien.
Wenn man nun die naturalistischen Studien zugunsten der randomisierten vernachlässigt, wie das im Moment gemacht wird, läuft man Gefahr äusserst zuverlässiges Wissen zu generieren, das aber entweder nur sehr begrenzt anwendbar ist oder das niemanden interessiert. Daher haben wir das zirkuläre Modell vorgeschlagen, das keine Informations- und Studienart bevorzugt, sondern davon ausgeht, dass alle Studien unterschiedliche Typen von Informationen bereit stellen, die für unterschiedliche Fragen von Bedeutung sind und daher alle berücksichtigt werden sollten. Eben im zirkulären Modell der Evidenz. Das ist zunächst eine, wie ich finde, einleuchtende theoretische Forderung. Die Frage aber ist: wie kann das konkret gelingen?
Den Schlüssel haben wir jetzt geliefert. Mit einem konkreten Anwendungsbeispiel in einer umstrittenen Thematik. Die Anwendung des zirkulären Modells gelingt, wenn man einen Bayesschen formalen analytischen Ansatz wählt, der Studien zubilligt unser Vorwissen zu verändern und dabei unterschiedlichen Studientypen unterschiedliches Gewicht verleiht. Der Vorteil einer Bayesschen Analyse ist dabei der, dass er unser Vorwissen, das eben durch unterschiedliche Daten erzeugt wird, mit in die Analyse einbezieht. Ich habe das schon einmal in einem Beitrag der Methodenlehre besprochen (Teil 5: Vom Verhältnis von Empirie und Theorie 1), daher hier nur kurz zur Erinnerung.
Bayessche Analyse
Der irische Pastor Bayes hatte erkannt, dass wir Entscheidungen treffen aufgrund von Vorwissen, das sich verändert, je mehr Information wir haben. Die nach ihm benannte Analyse fragt: Wenn ich bestimmtes Vorwissen habe, wie stark muss empirische Erkenntnis in die eine oder andere Richtung sein, um dieses zu verändern? Oder anders: Wenn all das Vorwissen, das wir haben, berücksichtigt wird, wie stark ist dann der Einfluss einer bestimmten Studie oder Erfahrung? Die Bayessche Analyse arbeitet also, anders als die klassische frequentistische Statistik, mit bedingten Wahrscheinlichkeiten. Sie formalisiert das Vorwissen als sog. „prior probability“ oder Ausgangswahrscheinlichkeit, nimmt ein neues Studienergebnis dazu und fragt dann, wie dieses neue Ergebnis diese Ausgangswahrscheinlichkeit verändert in die sog. „posterior probability“ oder in die Endwahrscheinlichkeit.
Wir Menschen sind alle Bayesianer. Denn wir haben alle formell oder informell Erfahrungen gesammelt. Auch die Wissenschaft geht implizit Bayesianisch vor. Das vorherrschende Weltbild, die berufliche oder wissenschaftliche Erfahrung, sie alle prägen eine implizite Ausgangswahrscheinlichkeit, aufgrund derer alle vorliegenden Daten, neue Studienergebnisse oder Erfahrungen interpretiert und gewichtet werden. Die Bayessche Analyse formalisiert nun einfach dieses Vorgehen, das wir sowieso immer an den Tag legen.
Die klassische Fishersche oder frequentistische Statistik imitiert den eigentlich nie vorkommenden Sonderfall, dass wir in einer bestimmten Fragestelltung komplett unentschieden sind, weil wir keinerlei Vorwissen haben, die „prior probability“, oder die Ausgangswahrscheinlichkeit also 50:50 oder ½ ist. Nur wenn das der Fall ist, ist die frequentistische Statistik im strengen Falle eigentlich anwendbar, sonst nicht. Darauf haben am Beispiel der Parapsychologie, wie ich meine zu Recht, Wagenmakers und Kollegen hingewiesen [5]. Allerdings müsste das nicht nur für die Psychologie gelten, sondern im Prinzip für alle Statistik, auch die Statistik, mit welcher klinische Studien ausgewertet werden.
Wir haben eben nun für ein Beispiel, das im Moment sehr kontrovers diskutiert wird, ein zirkuläres Synthesemodell mit Hilfe der Bayesschen Statistik aufgestellt. Es geht um die ketogene Diät bei hochgradigen Gliomen, einer schwer behandelbaren Art von Gehirntumor mit sehr schlechter Prognose.
Das klinische Beispiel: Ketogene Diät bei Hirntumoren
Unter „ketogener Diät“ versteht man eine Diät, die den Fastenstoffwechsel imitiert, einfach gesagt. Die biochemischen und physiologischen Hintergründe spare ich mir jetzt. Sie sind in der Originalpublikation und in einer anderen Publikation von uns auseinandergelegt, die ebenfalls online verfügbar ist [6]. Wenn wir fasten, baut der Körper Fett ab. Dabei entstehen kurzkettige Fettsäuren, sogenannte „Ketonkörper“. Die meisten Körperzellen, auch Nervenzellen, können aus diesen Ketonkörpern Energie gewinnen. Und die wenigen, die das nicht können, werden durch Zucker versorgt, der auf dem Weg der Zuckerneugewinnung aus Laktat, Glycerin oder glukogenen Aminosäuren in der Leber gebildet wird. Deswegen sterben wir auch nicht oder fallen in Ohnmacht, wenn wir fasten, sondern können das sogar recht lange durchhalten. Menschen, die es nicht gewohnt sind, fallen zunächst leicht in eine Unterzuckerung, aber das steht auf einem anderen Blatt.
Jedenfalls kann der Körper in einem Fastenmodus gut versorgt werden, wenn er sich von Ketonkörpern aus den eigenen Reserven ernährt. Jede Nacht tun wir das, ohne dass wir aufstehen müssen und uns ein Butterbrot streichen müssen, damit wir nicht verhungern. Bei der ketogenen Diät wird dies nun ausgenutzt, nur dass der Körper nicht auf die eigenen Reserven zurückgreift, sondern auf Eiweiss und Fett, das ihm durch die Nahrung zugeführt wird. Die ketogene Diät ist also eine Diät, bei der auf Kohlehydrate weitgehend verzichtet wird und die Ernährung vor allem über Fett- und Eiweisszufuhr und Kohlenhydrate überwiegend in komplexer Form (z.B. Salat und Gemüse) sicher gestellt wird. Eine solche Diät hat sich bei manchen neurologischen Erkrankungen bewährt, etwa bei Epilepsie. Sie wird aber auch bei Krebs eingesetzt [6, 7]. Das liegt daran, dass die meisten Krebszellen auf Zucker angewiesen sind, den sie direkt aus der Nahrung beziehen und sich nicht von Ketonkörpern ernähren können. Die ketogene Diät ist also so etwas wie ein Nahrungsentzugsprogramm für Krebszellen. Sie hat sich in vielerlei Hinsicht bewährt [7].
Wir haben nun ketogene Diät bei aggressiven Gliomen als Beispiel gewählt, weil hier, gerade im Sinne des hierarchischen Modells sehr wenig und unzureichende Information vorliegt. Denn es gibt nur drei Studien an Menschen und diese sind eher klein, teilweise mit komplexen anderen Verfahren verglichen oder liegen nur als Beobachtungsdaten vor, also nicht aus einer randomisierten Studie kommend. Daher würde ein klassischer Reviewer folgern: es gibt keine wissenschaftlichen Befunde. Deswegen kann die Therapie nicht empfohlen werden. Wenn man aber die vorhandenen 17 Tierexperimente und die Daten aus den Humanstudien zusammennimmt und die grundsätzlichen physiologischen Überlegungen, die wir ja nicht einfach ignorieren können, dazu gibt, dann ändert sich das Bild.
Die Analyse und die Einsicht
Nimmt man nämlich, so wie das zirkuläre Modell dies vorschlägt, alle Daten, also die 3 Humanmedizinischen und die 17 Tierstudien zusammen, dann kommt man zu einem anderen Ergebnis. Wir können nämlich bei einer solchen Analyse unterschiedliche Überlegungen formalisieren. Hier kommen z.B. Parameter zum Einsatz, für die man Annahmen treffen muss, deren Auswirkungen man dann in Sensitivitätsanalysen unmittelbar sieht. Wir haben etwa Parameter dafür angenommen, wie wichtig mechanistische Überlegungen sind, also das theoretische Wissen darüber, wie ketogene Diäten auf Gliome wirken. Dann wurde ein Parameter ins Modell eingesetzt, der formalisiert, wie gleichförmig die Effekte über bestimmte Klassen von Individuen hinweg sind – Menschen, Mäuse, Ratten. Schließlich haben wir auch noch Überzeugungen formalisiert, etwa die skeptische Überzeugung, dass Daten von Tieren nicht auf Menschen übertragbar sind, oder gar die fundamental skeptische Überzeugung, dass ketogene Diäten schädlich sind. Schließlich kann man noch weitere mechanistische Überlegungen mit einbeziehen, nämlich die Erkenntnis, dass ketogene Diät andere Formen der Therapie, etwa Bestrahlungen oder Chemotherapie unterstützt, indem die Diät den Tumor schwächt und anfälliger für den Radikalstress der Therapie macht. Wenn man sehr unterschiedliche Daten aus humanmedizinischen Studien gehabt hätte – etwa große Kohortenstudien, randomisierte Studie und Fallkontrollstudien – , dann hätte man auch noch Parameter einfügen können, die die Gewichtung der einzelnen Studien steuern.
All diese Parameter nehmen nun Einfluss darauf, wie die einzelnen Studien in einem Gesamtmodell verrechnet werden und wie die Aussage der Analyse bewertet wird. Ich gebe die Ergebnisabbildung aus der Originalpublikation hier wieder:
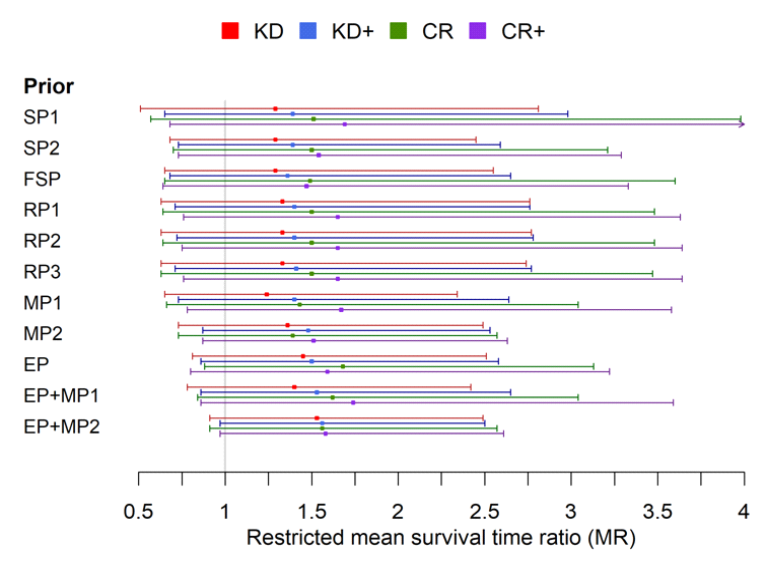
Die wichtigste Einsicht aus dieser Analyse ist wohl die, dass alle Daten darauf hinweisen, dass eine ketogene Diät einen leichten Überlebensvorteil bringt. Die Schätzungen liegen zwischen 1.2 und 1.5 bei einer ketogenen Diät und zwischen 1.5 und 1.7 bei einer kalorischen Restriktionsdiät mit einer Zusatzbehandlung. Wer also mit einer ketogenen Diät behandelt wird, hat eine etwa um 20 – 50% höhere Überlebenswahrscheinlichkeit. Zwar ist keiner dieser Befunde im strikten Sinne sicher, weil das Vertrauensinterval in jedem Fall die Linie der Unentschiedenheit, 1, mit einschließt, auch wenn die optimistischsten Schätzungen schon knapp heran reichen. Aber es ist doch erstaunlich, wie nahe beieinander die Schätzungen sind, sogar wenn man Skeptiker modelliert, also bei den skeptischen Priors (die ersten drei Linien in der Abbildung). Dass die Befunde so weit streuen zeigt, dass eben noch relativ wenige Daten vorliegen und die Unsicherheit groß ist. Dass die Schätzpunkte aber doch alle relativ nahe beieinander liegen zeigt, dass alle Daten in die gleiche Richtung weisen.
Das Ergebnis unserer Analyse wäre also: Ketogene Diät und kalorische Restriktion ist auf jeden Fall vielversprechend. Die Therapie verspricht eine um 50% höhere Überlebenswahrscheinlichkeit, im schlechtesten Fall um 20% und sollte auf jeden Fall weiter untersucht werden. Vor allem haben wir gezeigt, dass und wie Studien unterschiedlichen Typs in einem formalisierten, quantitativen Analysemodell zusammengeführt werden können.
Nun hoffen wir natürlich, dass der Impuls aufgegriffen wird und sich innovative Köpfe in der Cochrane- und EBM-Gemeinde auf den Weg machen und ihre Analysestrategien überdenken, vielleicht in einem zweifelhaften Fall eine solche eher zirkuläre Strategie anwenden und aufhören, 95% aller Daten, ob mechanistische Studien oder Kohortenstudien, über Bord zu werfen.
Quellen und Literatur:
- Klement, R. J., Bandyopadhyay, P. S., Champ, C. E., & Walach, H. (2018). Application of Bayesian evidence synthesis to modelling the effect of ketogenic therapy on survival of high grade glioma patients. Theoretical Biology and Medical Modelling, 15(12). https://tbiomed.biomedcentral.com/articles/10.1186/s12976-018-0084-y
- Klose, P., Kraft, K., Cramer, H., Lauche, R., Dobos, G., & Langhorst, J. (2014). Phytotherapie in den medizinischen S3 Leitlinien der Arbeitsgemeinschaft der Wissenschaftlichen Fachgesellschaften – eine systematische Übersichtsarbeit. Forschende Komplementärmedizin, 21, 388-400. https://www.karger.com/Article/FullText/370079
- Walach, H., Falkenberg, T., Fonnebo, V., Lewith, G., & Jonas, W. (2006). Circular instead of hierarchical – Methodological principles for the evaluation of complex interventions. BMC Medical Research Methodology, 6(29). https://bmcmedresmethodol.biomedcentral.com/articles/10.1186/1471-2288-6-29
- Walach, H., & Loef, M. (2015). Using a matrix-analytical approach to synthesizing evidence solved incompatibility problem in the hierarchy of evidence. Journal of Clinical Epidemiology, 68, 1251-1260. https://www.ncbi.nlm.nih.gov/pubmed/26148834;
- Wagenmakers, E. J., Wetzels, R., Borsboom, D., & van der Maas, H. (2011). Why psychologists must change the way they analyze their data: The case of psi: Comment on Bem. Journal of Personality and Social Psychology, 100, 426–432.
- Jansen, N., & Walach, H. (2016). The development of tumours under a ketogenic diet in ssociation with the novel tumour marker TKTL1: A case series in general practice. Oncology Letters, 11, 584-592. https://www.spandidos-publications.com/10.3892/ol.2015.3923
- Klement, R. J. (2018). Fasting, fats, and physics: Combining ketogenic and radiation therapy against cancer. Complementary Medicine Research, 25, 102-113. https://www.karger.com/Article/FullText/484045
